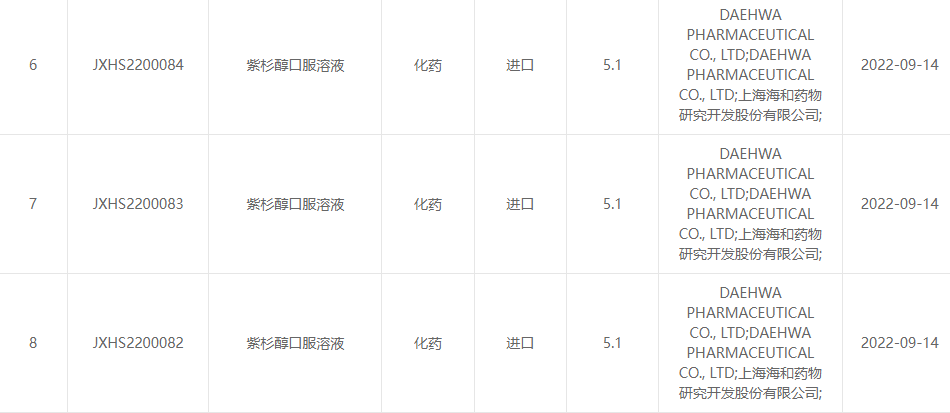
2022年9月13日、上海海和製薬研究開発有限公司と大和製薬株式会社は、両社が共同開発したパクリタキセル経口液剤(RMX3001)が医薬品センターから正式に承認されたと共同発表した。国家薬品監督管理局の評価 (CDE)。(受付番号:JXHS2200082国、JXHS2200083国、JXHS2200084国)。
画像出典: 国家薬品監督管理局
パクリタキセル肺がん、乳がん、卵巣がん、頭頸部がん、胃がんなどのさまざまな悪性腫瘍の治療に広く使用されています。タンパク質の重合、微小管の組み立て、解重合の防止により微小管を安定化し、がん細胞の有糸分裂を阻害し、アポトーシスを誘発することで、がん細胞の増殖を効果的に防ぎ、抗がん効果を発揮します。
現在、世界のほとんどの地域ではパクリタキセルが注射剤として使用されており、病院で製剤化して点滴投与する必要があります。患者は頻繁に病院に戻る必要があり、注射部位に副作用が生じる可能性があります。したがって、経口パクリタキセル製剤の開発は常に業界研究の注目の的となっています。。
RMX3001 は、Dahua Pharmaceutical が革新的な脂質自己乳化ドラッグデリバリー技術に基づいて開発したパクリタキセルの経口製剤です。2016年9月に韓国食品医薬品局により承認された薬剤(商品名リポラセル)は、転移性胃がんまたは局所再発胃がんの進行治療または二次治療を適応としています。Haihe Pharmaceuticals のプレスリリースによると、リポラセルは、これまでのところ世界で開発に成功し、販売が承認された初の経口パクリタキセル製品です。2017年9月、海河製薬は大華製薬から中国本土、香港、台湾、タイにおける同製品の研究開発、生産、販売権を取得した。
中国におけるRMX3001の収載申請は主に、無作為化、非盲検、並行対照、非劣性設計、多施設共同第3相臨床試験に基づいており、パクリタキセル経口液剤RMX3001とパクリタキセル経口液剤RMX3001の二次治療を比較することを目的としている。パクリタキセル注射(タキソール) 進行胃がん患者における有効性と安全性。この研究は、上海東方病院のLi Jin教授と南京金陵病院のQin Shukui教授が主任研究者として共同で実施された。
海河製薬の最高経営責任者、ドン・ルイピン博士は次のように述べています。「パクリタキセル経口液剤(RMX3001)の申請の受理は、海河製薬にとってもう一つの重要なマイルストーンであり、私たちの研究に参加した臨床研究者と患者に非常に感謝しています」トライアル。進行性胃がんには依然として治療に対する膨大な臨床ニーズが満たされておらず、私たちは世界最先端の革新的で便利な治療法を中国および世界中の患者にできるだけ早く提供したいと考えています。」
Yunnan Hande Biotechnology Co., Ltd. は、28 年間にわたりパクリタキセルの生産に注力してきました。同社は、米国FDA、欧州EDQM、オーストラリアTGA、中国CFDA、インド、日本およびその他の国家規制機関によって承認された植物由来の抗がん剤パクリタキセルの世界初の独立メーカーです。企業。購入したい場合はパクリタキセル原薬、オンラインでお問い合わせください。
投稿日時: 2022 年 9 月 14 日